Neuroblastoom
Neem het voorbehoud bij medische informatie in acht. Raadpleeg bij gezondheidsklachten een arts. |
Neuroblastoom | ||||
 | ||||
Microscopische opname van een typisch neuroblastoom met rosette formatie. | ||||
Coderingen | ||||
| ICD-10 | C74.9 | |||
| ICD-9 | 194.0 | |||
| ICD-O | M9500/3 | |||
| OMIM | 256700 | |||
| DiseasesDB | 8935 | |||
| MedlinePlus | 001408 | |||
| eMedicine | med/2836ped/1570 | |||
| MeSH | D009447 | |||
| ||||
Het neuroblastoom (synoniemen: Ziekte van Hutchinson, Sympathicoblastoom[1]) is de meest voorkomende buiten de schedel gelegen vaste tumor bij kinderen (onder een vaste of solide tumor verstaan we alle tumoren behalve leukemie).
Jaarlijks wordt de diagnose in Nederland 35 keer gesteld; de officiële incidentie is 1,1 nieuw geval per jaar per 100.000 inwoners.[2]
Bijna de helft van patiënten met neuroblastoom is minder dan 2 jaar oud.
Het is een neuroëndocriene tumor, dat wil zeggen dat hij is opgebouwd uit cellen die onder meer hormonen of boodschapperstoffen voor het zenuwstelsel kunnen vormen. De tumor komt voort uit het deel van de neurale lijst of crest dat het sympathische zenuwstelsel vormt; meestal komt de tumor voort uit het bijniermerg, maar de tumor kan ook ontstaan in het zenuwweefsel in de nek, de buik of het bekken.
Voor de patiënt en/of diens familie is van belang tot welke risicogroep hij behoort.
- Bij patiëntjes met een laag risico kan men volstaan met een operatie, of zelfs met afwachten.
- Bij patiëntjes met een middelmatig risico zijn er zeer goede vooruitzichten met een operatie en chemotherapie.
- Patiënten met een hoog risico wordt een zeer intensieve behandeling aangeboden; toch zijn de cijfers niet goed.
Het neuroblastoom is een van de zeldzame menselijke tumoren die spontaan terug kunnen gaan van een ongedifferentieerde (zeer kwaadaardige) tumor tot een tumor die er onder de microscoop volkomen goedaardig uitziet.[3] De ziekte loopt enorm uiteen wat verloop betreft en wordt ingedeeld in drie risico-categorieën: laag, middelmatig en hoog risico. Laag risico komt bij baby's het meeste voor en een goede afloop is dan mogelijk als alleen afgewacht of geopereerd wordt; maar ziekte met een hoog risico is moeilijk te behandelen, zelfs met de intensieve gecombineerde therapieën van tegenwoordig.[4]
Het esthesioneuroblastoom, het neuroblastoom van de reukzenuw, lijkt te ontstaan in de epitheelcellen van het reukzintuig en men is het er niet over eens hoe het ingedeeld moet worden. Het is in ieder geval geen tumor van het sympathische zenuwstelsel en geen echt neuroblastoom.[5][6]
Inhoud
1 Symptomen
2 Oorzaak
3 Diagnose
3.1 Biochemie
3.2 Beeldvorming
3.3 Microscopisch beeld
3.4 Stagering
4 Screening
5 Behandeling
6 Prognose
6.1 Cytogenetische profielen
7 Epidemiologie
8 Geschiedenis
Symptomen
In het begin zijn de verschijnselen slechts vaag, waardoor de diagnose moeilijk te stellen is. Vermoeidheid, gebrek aan eetlust, koorts en gewrichtspijn komen vaak voor. Verder hangen de verschijnselen samen met de plaats waar de primaire tumor zich bevindt en waar eventuele uitzaaiingen zich bevinden.[7]
- In de buik zal een tumor een opgezwollen buik en eventueel obstipatie veroorzaken.
- Een tumor in de borst kan kortademigheid tot gevolg hebben.
- Een tumor die op het ruggenmerg drukt, kan spierzwakte veroorzaken, waardoor de patiënt niet kan staan, kruipen of lopen.
- Aantasting van het bot van de benen en heupen veroorzaakt pijn en mank lopen.
- In de botten rond het oog en de oogkas, kan een tumor blauwe plekken en zwelling veroorzaken.
- Als er ingroei in het beenmerg is kan dat bloedarmoede veroorzaken.
Een neuroblastoom verspreidt zich dikwijls al door het lichaam voordat er verschijnselen zijn en in ongeveer de helft van alle gevallen zijn er al uitzaaiingen als de patiënt een arts bezoekt.[8]
De meeste neuroblastomen ontstaan in de bijnieren. Dit is het geval bij 40% van de plaatselijke tumoren en bij 60% van de kinderen met uitgezaaide tumoren. Een neuroblastoom kan zich ook ontwikkelen in de symathische grensstreng, het zenuwweefsel dat zich van de hals tot in het bekken langs de wervelkolom bevindt. Het bevindt zich dan in de nek (1%), borstkas (19%), buik (30% als we de bijniertumoren niet meerekenen), of bekken (1%). Soms, maar dat is zeldzaam, is er geen primaire tumor te vinden.[9]
Zeldzame, maar kenmerkende verschijnselen zijn een dwarslaesie (5%), onbehandelbare diarree (door een hormoon dat de tumor dan produceert) (4%), het syndroom van Horner (door een tumor in de hals; 2.4% van alle gevallen), opsoclonus-myoclonussyndroom (2 à 3 %)[10], ataxie (vermoedelijk paraneoplastisch van aard, 1.3% van alle gevallen), en hoge bloeddruk door catecholamineproductie of door druk op de nierslagader (1.3% van de gevallen).[11]
Oorzaak
Er is nog niet veel bekend over de oorzaak van het neuroblastoom. Soms komen meerdere gevallen in een familie voor en is er een verband gevonden met erfelijke eigenschappen. Het familiaire neuroblastoom wordt veroorzaakt door een zeldzame mutatie in het ALK (anaplastisch lymfoomkinase)-gen.[12]
Er is een koppeling gevonden tussen het neuroblastoom en het NBPF10-gen in relatie met het 1q21.1-deletiesyndroom en het 1q21.1-duplicatiesyndroom.[13]
Er is een aantal risicofactoren geopperd waarnaar onderzoek plaatsvindt. Omdat de tumor zo vroeg in het leven ontstaat heeft men veel onderzoek gedaan naar omgevingsfactoren rond de bevruchting en tijdens de zwangerschap. Er is (nog) geen overtuigend verband gevonden met beroep, roken, alcoholgebruik, gebruik van medicijnen en invloeden rondom de geboorte.[14]
Diagnose
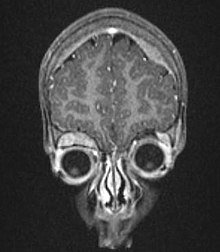
MRI van een uitzaaiing in de oogkas en de schedel; patiënt is twee jaar oud.
De diagnose wordt uiteindelijk gesteld door de patholoog-anatoom waarbij de verschijnselen, het microscopische beeld en andere laboratoriumonderzoeken een rol spelen.
Biochemie
Ongeveer 90% van alle patiënten met een neuroblastoom heeft verhoogde catecholamines of afbraakproducten daarvan in urine of bloed. Catecholamines en hun afbraakproducten zijn dopamine, homovanillinezuur (HVA), en vanyl mandelic acid (VMA).[15]
Beeldvorming
90 tot 95% van de neuroblastomen is op te sporen met de mIBG- scan (meta-iodobenzylguanidine),[16] mIBG wordt opgenomen door sympathische zenuwcellen, en functioneert net als de neurotransmitter noradrenaline. Als het gebonden is aan de radioactieve isotoop Jodium-123[17] is het een zeer geschikt middel om neuroblastoom op te sporen en om het effect van de behandeling te meten.
Microscopisch beeld
Onder de microscoop zijn de tumorcellen klein, rond en blauw, en vormen een rosettepatroon. Ook pseudorosetten
zijn beschreven, waarbij de tumorcellen niet rond een bloedvat maar rondom een uitloper van een zenuwcel (een neutropil) zijn gegroepeerd.
Het neuroblastoom is een van de perifere neuroblastische tumoren (pNT) en heeft eenzelfde soort oorsprong en heeft een breed patroon van differentiatie (uitgroeien tot een bepaald soort cel) variërend van goedaardig .ganglioneuroom via een stromarijk ganglioneuroblastoom met een mengsel van neuroblastoom-cellen in groepjes, tot een zeer kwaadaardig neuroblastoom.
Dit onderscheid is samen met de leeftijd en de mitose-karyorhexis (kapot gaan van de celkern)-verhouding een belangrijk middel te bepalen of de vooruitzichten "gunstig " of "ongunstig " zijn. In 1999 is hier een indeling voor gemaakt, die in 2003 is herzien.[18]
Stagering
In 2005 heeft men het verloop van de ziekte van 8800 patiënten met neuroblastoom die tussen 1990 en 2002 in de westerse wereld, China en Japan behandeld waren, onderzocht. Het bleek dat kinderen van 12-18 maanden die geen N-Myc amplificatie (een bepaalde afwijking van het DNA van de tumor) hadden, een kleiner risico hadden dan altijd was gedacht.[19]
Op grond hiervan is een nieuw internationaal stageringssysteem ingevoerd, het International Neuroblastoma Risk Group Staging System (INRGSS):
- Stadium L1: Gelokaliseerde ziekte zonder chirurgische risicofactoren bij beeldvormend onderzoek (CT of MRI).
- Stadium L2: Gelokaliseerde ziekte met risicofactoren bij beeldvormend onderzoek.
- Stadium M: Uitgezaaide ziekte.
- Stadium MS: Uitgezaaide ziekte "speciaal". Leeftijd jonger dan 18 maanden met gelokaliseerde primaire tumor (al dan niet geheel verwijderd, zonder dat de onderzochte lymfklieren zijn aangedaan, waarbij de uitzaaiing beperkt is tot lever, huid, of beenmerg (minder dan 10% van de kernhoudende cellen in het beenmerg zijn tumorcellen).
De nieuwe risico-bepaling zal gebaseerd zijn op dit nieuwe INRGSS stageringssystem, de leeftijd (jonger of ouder dan 18 maanden), het microscopische beeld van de tumor, en de volgende afwijkingen van het erfelijk materiaal van de tumor: N-myc amplificatie, ongebalanceerde afwijking van 11q; en verdubbelig of verdrievoudiging enz van alle chromosomen. Indeling zal plaatsvinden in vier groepen: zeer laag risico, laag, middelmatig en hoog risico.[20][21]
Screening
Het catecholamine gehalte van de urine kan verhoogd zijn bij een onbehandeld neuroblastoom. Sinds de jaren tachtig zijn er in Japan, Canada, Oostenrijk en Duitsland baby’s gescreend op de leeftijd van drie weken, zes maanden en een jaar.[22][23] Deze screening is in 2004 stopgezet, omdat het aantal doden door neuroblastoom niet verminderde, maar er wel meer tumoren werden gediagnosticeerd die anders spontaan waren verdwenen, waardoor kinderen onnodig behandeld werden.[24][25][26]
Behandeling
Een gelokaliseerde afwijking is meestal te genezen. De vooruitzichten voor kinderen van ouder dan anderhalf jaar met een gevorderde ziekte zijn echter somber, ook al wordt agressieve gecombineerde therapie ingezet (intensieve chemotherapie, chirurgie, bestraling, stamceltransplantatie ,isotretinoine en immunotherapie[27] met anti-GD2; behandeling met monoclonale antistoffen).
Zoals boven beschreven, zijn er biologische en genetische kenmerken in kaart gebracht, die samen met de klassieke stagering, de behandelaars in staat stellen om de agressieve behandeling gericht te geven aan patiënten met een hoog risico.[28].
Van 2687 patiënten had 37% een laag risico; 18% een middelmatig risico en 45% had een hoog risico.[29]
Er zijn aanwijzingen dat de hoog-risicotypes en de laag-risicotypes verschillende ziekten zijn.[30] De behandelingsvoorstellen zullen voor de twee groepen dan ook zeer uiteen lopen:
- Bij patiënten met een laag risico kan vaak worden afgewacht, of worden volstaan met alleen een operatie.[31]
- Patiënten met een middelmatig risico wordt een behandeling aangeboden die bestaat uit een operatie en chemotherapie.[32]
- Een neuroblastoom met een Hoog risico wordt behandeld met intensieve chemotherapie, operatie, bestraling, beenmerg- of stamceltransplantatie,[33] biological-based therapy with 13-cis-retinoic acid (Isotretinoïne (Roaccutane(R))[34] en een behandeling met monoclonale antistoffen, die meestal wordt gecombineerd met de cytokinen GM-CSF en Interleukine 2.[35]
Met de huidige behandeling hebben patiënten met een laag risico (meer dan 90% genezing) en een middelmatig risico (70-90% genezing) uitstekende vooruitzichten. De behandeling van hoog-risicopatiënten had echter de afgelopen 20 jaar slechts een succespercentage van ongeveer 30% .[36] De toevoeging van behandeling met antilichamen heeft de overlevingskansen van patiënten met een hoog risico significant doen stijgen. In maart 2009 bleek dat 66% van kinderen die na een stamceltransplantatie behandeld waren met
ch14.18 antistoffen met GM-CSF en IL-2 in leven en ziektevrij waren tegenover 46% van de groep die deze antistoffen niet had gekregen. Daarop stopte men het onderzoek en gaf elke deelnemer de antistoffen.[37]Chemotherapie is het effectiefst wanneer een combinatie van middelen wordt gegeven. Middelen die worden toegepast zijn cisplatinum, carboplatinum), alkylerende middelen zoals cyclofosfamide, ifosfamide, melfalan); topoisomerase II-remmer (etoposide), anthracycline, celdodende antibiotica (doxorubicine) en vinca-alkaloïden, zoals (vincristine). Enkele nieuwe strategieën maken voor de inductie gebruik van de topoisomerase I-remmers topotecan en irinotecan die effectief bleken te zijn bij een recidief.
Prognose
De laag- risico en de middelmatig-risicopatiënten hebben een overleving van meer dan 90%, respectievelijk 70-90%.
Tussen de 20 % en de 50% van de hoog-risicopatiënten reageren onvoldoende op de eerste chemotherapie.[38][39]
Terugkeer van de ziekte na voltooiing van de modernste behandeling komt bij hen vaak voor. Verdere behandeling is dan mogelijk in onderzoeksverband waarin nieuwe behandelingen worden uitgetest.[40]
Kinderen die de ziekte langdurig overleven, hadden dikwijls tevoren een laag of middelmatig risico en ondergingen een relatief milde behandeling. De meesten van hen ondervinden op lange termijn gevolgen van de behandeling. Overlevenden uit de groepen met een middelmatig of een hoog risico houden vaak een gehoorverlies aan de behandeling over. Kinderen uit de groep met hoog risico kunnen minder lengtegroei, schildklierstoornissen en leermoeilijkheden ondervinden en hebben een verhoogde kans om later op een andere plek kanker te krijgen.[41][42] Twee van de drie kinderen die het overleven hebben 20 à 30 jaar later minstens één, chronisch, vaak levensbedreigend gezondheidsprobleem.[43][44] Deze gegevens worden bevestigd door een onderzoek uit 2009, waarin ex-patiënten werden vergeleken met hun broers en zusters. Patiënten bleken vaker dan hun broers of zussen chronische neurologische stoornissen te hebben of hinder te hebben van zintuigelijke, endocriene stoornissen of afwijkingen van het bewegingsapparaat te hebben. Ze waren minder vaak getrouwd en hadden minder vaak een hoog inkomen.[45]
Cytogenetische profielen
Afwijkingen van het erfelijk materiaal van de tumorcellen blijkt het verloop van de ziekte te voorspellen.[46]
- Patiënten met een tumor die alleen hele chromosomen te veel of te weinig heeft , hebben in de regel een uitstekende overlevingskans.
- Patiënten met een tumoren met afwijkingen van gedeelten van chromosomen, hadden een grote kans dat de tumor weer terugkwam.
- Binnen deze groep hadden de volgende afwijkingen voorspellende waarde: N-myc amplificatie, 1p and 11q deleties, en verlenging van 1q.
Eerder had men de neuroblastomen al op grond van de genetische profielen in drie subtypes ingedeeld:[47]
- Subtype 1: gunstig neuroblastoom met bijna triploidie (drie chromosomen per cel in plaats van 2) waarbij vaak afwijkingen van het aantal chromosomen, dit wordt meestal gevonden in de niet uitgezaaide neuroblastomen, stadia 1, 2 and 4S.
- Subtype 2A and 2B: wordt gevonden in ongunstige, uitgezaaide neuroblastomen, stadia 3 en 4, met 11q deletie en 17q verlenging; zonder N-myc amplificatie (subtype 2A) of met N-myc amplificate en 1p deletie en 17q verlenging (subtype 2B).
Epidemiologie
Bij 6-10% van alle kanker in de kindertijd en bij 15% van overlijden aan kanker op de kinderleeftijd is er sprake van een neuroblastoom.
De meeste nieuwe gevallen treden in het eerste levensjaar op, soms is het neuroblastoom bij de geboorte al aanwezig. Er is echter een brede leeftijdsspreiding, ook bij oudere kinderen en volwassenen komt de tumor voor[48], hoewel slechts 10% ouder is dan vijf jaar.[16] Minder dan 2% is ouder dan 18 jaar.[49]
Geschiedenis

Rudolf Virchow was de eerste die een tumor in de buik van een kind beschreef als een "glioom"
In 1864 was de Duitse arts en grondlegger van onder meer de pathologie Rudolf Virchow de eerste die een tumor in de buik van een kind beschreef als een "glioom". In 1898 merkte de Duitse patholoog de kenmerken van het bijniermerg op.[50][51] In 1901 beschreef William Pepper het afwijkende verloop en de bijzondere presentatie van stadium 4S in baby's (uitzaaiing naar de lever, maar niet naar de botten). In 1910 begreep James Homer Wright dat de tumor ontstond uit primitieve zenuwcellen en noemde hem daarom neuroblastoom. Hij ontdekte ook de bloemachtige motieven in het beenmerg, die nu zijn naam dragen ("Homer-Wright pseudorosetten.")[52]
Bronnen, noten en/of referenties
|