Metaal
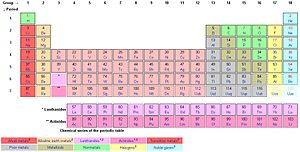
Het periodiek systeem der elementen met 90 stabiele elementen, waarvan ongeveer 65 elementen tot de metalen behoren en slechts een kleine 25 elementen metalloïden en metalloïde halfgeleiders, niet-metalen, halogenen en edelgassen zijn

Gloeiend heet metaal
Een metaal is een scheikundig element uit een van de volgende reeksen in het periodiek systeem der elementen:
- Alkalimetalen
- Aardalkalimetalen
- Overgangsmetalen
- Hoofdgroepmetalen
In het periodiek systeem bevinden deze elementen zich alle links van de semi-metalen, of metalloïden. De metalloïden liggen op een diagonale lijn, van boor (B) tot astaat (At).
Enkele algemeen bekende metaalsoorten zijn: ijzer, aluminium, koper, chroom, nikkel, lood, zink, tin, goud, zilver en platina en ook enkele legeringen die gemaakt zijn van metalen, zoals: brons, messing, inox, en soldeersel.
Inhoud
1 Eigenschappen van metalen
1.1 Chemische eigenschappen
1.2 Fysische eigenschappen
2 Legeringen
3 Productie van metaal
4 Ferro en non-ferro
5 Ferromagnetisme
6 Toepassingen
7 Edele en onedele metalen
8 Zie ook
Eigenschappen van metalen
Chemische eigenschappen
Het belangrijkste kenmerk van metalen is hun kleine elektronegativiteit. Door deze kleine elektronegativiteit binden ze elektronen niet sterk aan de kern en vormen daardoor gemakkelijk positief geladen ionen en kunnen ze reageren met stoffen die negatief geladen ionen vormen, waarbij een zout gevormd wordt.
De meeste metalen zijn chemisch stabiel. Echter, metalen uit de reeksen van de alkalimetalen (bijvoorbeeld natrium) en aardalkalimetalen (zoals magnesium) zijn zeer reactief. Deze metalen vormen 1+ en 2+ positief geladen ionen die de elektronen uit hun s-schillen kwijt zijn. Zouten van deze metalen zijn over het algemeen goed oplosbaar in water, dat geldt vooral voor de zouten van alkalimetalen. De ionen van cesium-137 en -135 en van strontium-90 die als bijproduct gevormd worden bij het radioactief verval tijdens de opwekking van kernenergie verspreiden zich daarom gemakkelijk in het milieu als ze vrijkomen.
Hoe edeler een metaal is, hoe moeilijker een metaal reageert. Metalen die niet reageren met zuurstof en water, die dus geen corrosie vertonen, noemen we edel. Onedele metalen vertonen wel corrosie. Er bestaan ook metalen die erg gemakkelijk met water reageren; dit zijn de zeer onedele metalen. Voorbeelden hiervan zijn natrium en kalium.
De overgangsmetalen uit de platinagroep en kopergroep zijn relatief inert. De edelmetalen uit periode-5 en 6 van deze groepen, zoals goud, zilver en platina zijn chemisch vrijwel volledig inert. Ze reageren net als de edelgassen met vrijwel geen enkele stof.
Fysische eigenschappen

Metalen wijwaterbakje voor aan de wand
Metalen hebben een aantal kenmerkende fysische eigenschappen:
- ze hebben meestal een glimmend uiterlijk
- ze hebben een hoge taaiheid en zijn vervormbaar
- ze hebben meestal een hoog smeltpunt; met uitzondering van kwik en gallium zijn alle metalen vaste stoffen bij kamertemperatuur
- ze zijn goede geleiders van warmte en elektriciteit
Deze eigenschappen zijn hoofdzakelijk het gevolg van het feit dat de elektronen op de buitenste elektronenschil zeer los gebonden zijn. In een metaalkristal worden deze valentie-elektronen dan ook gedeeld over de atomen in het volledige kristalrooster, zodat sprake is van een gemeenschappelijke elektronenwolk (valentieband).
IJzer, nikkel, kobalt en enkele metaallegeringen kunnen magnetisch gemaakt worden.
Legeringen
Een legering is een mengsel van metalen. Een legering kan ook wel niet-metalen bevatten. Legeringen worden geproduceerd om aan metalen de gewenste eigenschappen, zoals hardheid en smeedbaarheid te verschaffen. In de bronstijd (± 2000 - 1000 voor Chr.) wist men reeds hoe men van koper een legering kon maken die gemakkelijker te bewerken was door er tin aan toe te voegen. Deze legering heet brons.
Productie van metaal
Met uitzondering van edelmetalen worden metalen in de natuur zelden in zuivere vorm gevonden. Metalen worden gedolven in de vorm van ertsen, die vervolgens worden omgezet in de zuivere metaalvorm. Voorbeelden hiervan zijn de winning van gietijzer uit ijzererts door middel van hoogovens of de elektrochemische omzetting van bauxiet in aluminium.
Ferro en non-ferro
In de metaalhandel wordt onderscheid gemaakt tussen de ferrometalen en non-ferrometalen. IJzer en alle legeringen op basis van ijzer worden ferrometalen genoemd, en de overige metalen, zoals aluminium, goud en koper, worden non-ferrometalen genoemd.
Ferromagnetisme
Hoewel veel metalen een magnetisch gedrag vertonen worden er maar een paar direct aangetrokken door een magneet. Dit verschijnsel heet ferromagnetisme ("ferro" van ijzer). Het bekendste ferromagnetische metaal is ijzer, maar ook metalen als kobalt en nikkel vertonen deze eigenschap.
Toepassingen

Een brug gemaakt van metaal
Metalen hebben zeer veel toepassingen. Onderstaande lijst dient enkel om een indruk te geven van de veelzijdigheid van metalen. Zo worden zij toegepast in:
constructies, machines en vervoermiddelen (staal, aluminium, zink, magnesium)- verpakkingsmateriaal zoals blik voor conserven, drank en verf (tin, aluminium)
- elektrische verbindingen (koper, goud, zilver)
kwikbarometers en thermometers (kwik)
magneten (ijzer, nikkel, neodymium, kobalt)
pigmenten (lood, kwik, cadmium)
ballast in de kiel van schepen, of als contragewicht (lood, wolfraam, uranium)
projectielen en slagwapens (koper, lood)- chemische katalysatoren (rodium, ruthenium, palladium)
- kunstvoorwerpen (goud, zilver, koper, tin)
- belegging (edelmetalen) en betaalmiddel (goud, zilver, nikkel, koper)
geneesmiddel (lithium, technetium, platina)
vergif (arseen, thallium)
Edele en onedele metalen
De metalen die vooraan in groep 1 van het periodiek systeem staan zijn zeer onedel: ze reageren zeer gemakkelijk, worden vlot geoxideerd en komen daardoor ook alleen maar als verbinding in de natuur voor. Natrium en kalium reageren zeer heftig met water onder vorming van waterstofgas en warmte (vaak met brand tot gevolg), en moeten in hun elementaire toestand bewaard worden onder petroleum of minerale olie. De metalen uit groep 1 worden de alkalimetalen genoemd.
De metalen uit groep 2 van het periodiek systeem zijn bijna net zo reactief: ze reageren veel minder uitgesproken met water, maar komen ook niet in elementaire vorm voor in de natuur. Voorbeelden zijn: magnesium, calcium, barium en strontium, waarvan calcium het minst edel uit die reeks is. Deze groep metalen worden aangeduid als de aardalkalimetalen. Ook aluminium is zeer onedel en reageert gemakkelijk met zowel sterke als zwakke zuren en basen. IJzer is eveneens relatief onedel: in zuurstof- en waterrijke omgevingen wordt ijzer geoxideerd tot de overeenkomstige oxiden. Dit verschijnsel staat bekend als roest.
Metalen kunnen ook halfedel zijn, ze komen soms in de vrije natuur als element voor, maar kunnen ook nog redelijk makkelijk in ionaire toestand over gaan. Enkele voorbeelden van halfedele metalen zijn: koper, lood, nikkel, cadmium, kobalt en zink. Om deze metalen te doen overgaan in oplossing is een sterke (zure) oxidator (zoals zwavelzuur) nodig.
Zeer edele metalen komen meestal in de natuur als element voor, ze zijn relatief zeldzaam en vormen minder snel een zout. Om edele metalen te doen overgaan in een zout is een zeer sterke oxidator nodig, zoals nitrosylchloride in koningswater. Voorbeelden zijn: zilver, goud en platina. In deze reeks is zilver het minst en goud het meest edel.
Het edele dan wel onedele karakter van een metaal kan op elektrochemische wijze in verband worden gebracht met diens standaardelektrodepotentiaal: metalen met een sterk negatieve standaardelektrodepotentiaal, zoals lithium en kalium, worden zeer vlot geoxideerd, terwijl metalen met een positieve standaardelektrodepotentiaal, zoals goud en zilver, veel moeizamer geoxideerd worden.
Zie ook
- Metaalbewerking
- Metaalbinding
- Metaalkunde
- Metallurgie
- Onedele metalen
- Staal
- Zwaar metaal
| Zie de categorie Metals van Wikimedia Commons voor mediabestanden over dit onderwerp. |
| Zoek metaal in het WikiWoordenboek op. |